1 Ответ
1: Нагревание металла X в токе жёлто‑зелёного газа Y приводит к образованию фиолетовых кристаллов вещества Z. B результате эксперимента было обнаружено, что из 1.000 г X образуется 2.286 г Z (выход 75 %).
Запишите символ элемента, образующего соединение X= Cr
Запишите брутто-формулу вещества Z = CrCI13
Определите теоретическую массу Z, которая могла быть получена в результате эксперимента. Ответ выразите в граммах, округлите до целых. — 3
2: При добавлении к водному раствору вещества X (ω(Na)=29.11 %; ω(S)=40.51 %; ω(O)=30.38 %) разбавленной серной кислоты происходит выделение сернистого газа и помутнение раствора за счёт образования простого вещества жёлтого цвета.
Определите молярную массу X. Ответ выразите в г/моль, округлите до целых.= 158
Определите сумму минимальных целочисленных коэффициентов в уравнении реакции взаимодействия раствора X с разбавленной серной кислотой.= 6
3: На простые вещества действовали указанными в таблице реагентами. Также приведены некоторые продукты реакций, общее число которых составляло от 1 до 3. Заполните пропуски формулами этих простых веществ.
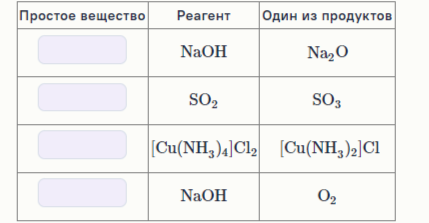
Ответ: Na, O2, Cu, O3
4: Какие из перечисленных неорганических веществ способны практически необратимо реагировать с водой при комнатной температуре? —
P4O10, Li, PCl3, CaH2, CO2, P4, SiO2, Fe, F2, SO3, N2O, ZnO, Al2S3, MgO
5: После взаимодействия 50 мл 0.07 моль/л раствора мышьяковой кислоты (H3AsO4 ) и 140 мл раствора гидроксида натрия в сосуде, помимо воды, была обнаружена лишь смесь солей в равном количестве. При этом в полученном растворе соотношение атомов натрия и мышьяка равно 3:2 соответственно. Сколько различных солей входит в полученный раствор?
Определите концентрацию исходного раствора гидроксида натрия. Ответ выразите в миллимоль/литр, округлите до десятых.
6: Определите концентрацию исходного раствора гидроксида натрия. Ответ выразите в миллимоль/литр, округлите до десятых.
Определите число протонов в молекуле простого вещества, которое образуется в результате протекания реакции: KI+KIO3+H2SO4=
Определите сумму минимальных целочисленных коэффициентов в уравнении реакции: Cl2+KI+KOH=KIO3+…
Определите степень окисления, в которую перейдёт элемент‑восстановитель в результате протекания реакции (например, +4 или −2 ): Cl2+Fe=
7: При сгорании 16.4 г газовой смеси этана (C2H6 ) и пропана (C3H8 ) образуются только углекислый газ, вода и выделяется 844.2 кДж теплоты. Теплоты сгорания этана и пропана равны 1560 и 2206 кДж/моль соответственно.
Запишите коэффициент перед кислородом в уравнении реакции сгорания пропана, если все коэффиценты — наименьшие целые числа.
Определите молярное соотношение этана и пропана n(C2H6)/n(C3H8) в смеси. Ответ округлите до целых.
8: Соединение 18F -дезоксиглюкоза, имеющее формулу C6H11O185F , широко используется в ядерной медицине для проведения позитронно‑эмиссионной томографии. 18F -дезоксиглюкоза быстро распадается, поэтому её получают непосредственно перед проведением томографии. Определите массовую долю фтора в 18F -дезоксиглюкозе. Ответ выразите в процентах, округлите до целых. При расчётах атомные массы всех элементов округляйте до десятых.
Сколько 18F будет в теле пациента непосредственно перед томографией, если изначально выделяют 0.1 граммa 18F -дезоксиглюкозы, 15 % вещества распадается с момента получения до введения пациенту, а 15 % от введённого количества распадётся до момента непосредственного проведения томографии? Ответ выразите в миллиграммах, округлите до сотых.
9: Соединение Ba2XO6 при нагревании разлагается с образованием оксида бария и смеси газов, которая состоит из двух простых веществ, причём одно из них является одноатомным. Эта смесь имеет плотность по водороду, равную 35.86 .
Определите мольное соотношение между двумя газами в смеси, разделив большее количество на меньшее. Ответ округлите до десятых.
Запишите химический символ элемента X
10: Дан набор газов: HCl , CO2 , NH3 , H2 , O2 , HI . Какие из них можно сушить над концентрированной серной кислотой?
Какие из них можно сушить над концентрированной серной кислотой?
HCl, CO2, NH3, H2, O2, HI
Выберите два газа, смесь которых НЕ может быть тяжелее воздуха.
HCl, CO2, NH3, H2, O2, HI
11: Определите типы кристаллических решёток перечисленных соединений (при условии, что они находятся в твёрдом состоянии), а также типы связей для некоторых из них.
Fe
HF
LiF
Na2SO4
Si
H2O
Молекулярная решётка, Атомная решётка, Ионная решётка, Металлическая решётка, Металлическая связь, Ковалентная неполярная связь
12: Природный уран почти полностью состоит из изотопа с массовым числом, равным 238 . Этот изотоп последовательно распадается с выделением альфа-частиц и электронов, а конечным продуктом распада является стабильный свинец-206 . Альфа-частицей называют ядро атома гелия‑4 . Сколько альфа-частиц получится из одной частицы урана-238 , когда тот превратится в свинец-206 ?
Уран-238 распадается так медленно, что скорость его распада можно считать постоянной на протяжении многих лет — 12.5 тысяч распадов в секунду на 1 грамм изотопа. Определите активность источника массой 25 кг, содержащего 0.5 % урана-238 по массе. Ответ выразите в тысячах распадов в секунду, округлите до целых.
Ответы на задания появятся чуть позже.
