1 Ответ
1: Вещество X , содержащее 5 атомов — дымящая на воздухе тёмно‑красная жидкость. Данное вещество используется в качестве окислителя в органическом синтезе. Максимальный выход вещества X достигнут в реакции сухого хлороводорода с тёмно‑красными кристаллами Y в присутствии двухосновной кислоты K (98 г/моль) на холоде. Вещество Y (100 г/моль) — ангидрид кислоты Z1 (118 г/моль) и кислоты Z2 (218 г/моль). Определите количество атомов, составляющих молекулы веществ.
Запишите молекулярную формулу вещества X. Определите сумму наименьших целых коэффициентов в уравнении реакции полного гидролиза X с образованием Z2.- Y-CrO3, Z1-H2CrO4. Z2-H2Cr207, K-H2SO4, X-CrO2Cl2, 10
2: Частица NO+2 часто выступает в качестве интермедиата в реакциях нитрования органических соединений.
Определите степень окисления атома азота в этой частице.
Какую геометрическую форму имеет катион NO+2NO2+? +5
Тетраэдр
Треугольник
Т‑образная
Линейная
Угловая
3: Радиоактивный изотоп элемента X, в ядре которого 40% нуклонов приходится на протоны, при радиоактивном распаде выделяет одну α -частицу и превращается в изотоп элемента Y, ядро которого содержит 39.806 % протонов. Определите зарядовое и массовое числа описанного изотопа элемента X.
Примечание: Альфа‑частица представляет собой ядро гелия-4.
Зарядовое число: 92
Массовое число: 230
4: Расположите вещества в порядке увеличения pH их 0.1 М водных растворов.
Хлорид аммония NH4Cl
Азотная кислота HNO3
Аммиак NH3
Гидразин NH2−NH2
Гидроксиламин NH2OH
5: Дана цепочка превращений н-бутиловый спирт
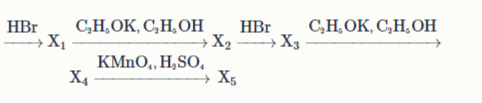
Определите молярную массу X5. Ответ выразите в г/моль, округлите до целых.
Определите сумму минимальных целых коэффициентов в последней реакции.
азотная кислота HNO3, хлорид аммония NH4CI, гидроксиламин NH2OH, гидразин
NH2-NH2, аммиак NH3
6: Сколько существует изомерных соединений состава C6H5NO2 , содержащих в своём составе бензольное кольцо и не содержащих других циклов?
Сколько из этих изомеров способны образовывать внутримолекулярную водородную связь?
7: Дана схема превращений металла X, входящего в состав термитной смеси.
Определите формулы всех зашифрованных соединений.
Определите сумму наименьших целочисленных коэффициентов в уравнении реакции металла X с очень разбавленной азотной кислотой, если известно, что в ходе реакции образуется нитрат аммония.
8: Восстановите левые части уравнений реакций. В ответ запишите сумму наименьших целочисленных коэффициентов в каждом из них.
…………+ …………= PbSO4+4H2O
…………+ …………= 3Zn+SO2
9: Двойная соль X , содержащая в своем составе Fe (II), находит широкое применение в пищевой промышленности. При добавлении к раствору двойной соли X избытка щёлочи и последующем нагревании раствора происходит выделение резко пахнущего газа, окрашивающего лакмусовую бумажку в синий цвет.
При добавлении к раствору навески 0.050 г (по массе) раствора двойной соли X избытка раствора хлорида бария выпадает 59.5 мг белого осадка, нерастворимого в кислотах и щелочах, а на титрование полученного в ходе реакции с хлоридом бария раствора необходимо 5.10 мл 5.00⋅10−3 М раствора KMnO4 .
Запишите название аниона, входящего в состав двойной соли.
Запишите название катиона, ответственного за выделение из раствора резко пахнущего газа.
Определите число молекул кристаллизационной воды, содержащихся в двойной соли X
10: При сжигании 1 моль графита в недостатке кислорода при температуре 800 K образовалась смесь CO2 и CO суммарным объёмом 22.40 литра (при н.у.), а также выделилось 333.22 кДж теплоты. Если пропустить полученную смесь газов через раствор KOH , то масса этого раствора увеличится на 35.20 г. Полученный после пропускания через раствор KOH газ сгорает в избытке кислорода с выделением 56.18 кДж теплоты.
Определите стандартные теплоты образования CO2(г) и CO(г) при температуре 800 K. Ответ выразите в кДж/моль, округлите до целых.
CO2(г) :
CO(г) :
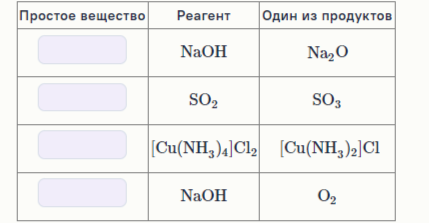
11: В таблице приведены все продукты некоторых реакций без стехиометрических коэффициентов. Запишите формулы реагентов, если известно, что взаимодействовали только два вещества.
Реагенты
Продукт реакции
HCOONa, CrO3+KHSO4+H2O, (NH4)2[BeF4]+H2+NH3, Fe(OH)3
12: В трёх пронумерованных пробирках находятся крепкие растворы неорганических веществ. С веществами провели некоторые опыты, результаты которых представлены в таблице.
Известно, что соль 1 окрашивает пламя горелки в желто‑зелёный цвет. Запишите формулы веществ
Ответы на задания появятся немного позже.
