1 Ответ
1: В колбу Вюрца поместили кристаллы перманганата калия. Капельную воронку наполнили концентрированным раствором вещества А. Когда открыли кран капельной воронки, раствор А начал взаимодействовать с кристаллами перманганата калия в колбе Вюрца, при этом выделялся газ Б, простое вещество жёлто-зелёного цвета, и его собирали в цилиндр. Заполнив цилиндр на половину объёма, опыт прекратили.
В аппарат Киппа поместили гранулы цинка и залили раствор вещества А. При взаимодействии раствора А с цинком выделялся бесцветный газ В, который собирали в цилиндр, наполовину заполненный газом Б.
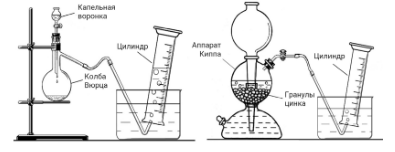
Цилиндр, заполненный смесью газов Б и В, неплотно закрыли пробкой, извлекли из ванны и осветили яркой вспышкой света. В результате очень быстрой реакции образовался газ A.
Газ А хорошо растворяется в воде. Раствор А реагирует с питьевой (пищевой) содой. В результате реакции выделяется газ Г, а в растворе образуется соль Д.
Запишите формулы веществ.
2: Вещество состоит из ионов, имеющих одинаковую электронную конфигурацию. Масса положительного иона более чем втрое превышает массу отрицательного иона.
Запишите формулу вещества.
Запишите электронную конфигурацию ионов, входящих в состав вещества (пример записи: 1s2 2s2 2p2). Строение каждого подуровня записывайте в отдельное поле, добавляя необходимое количество.
Формула вещества: A3B
Электронная конфигурация положительного иона (A3+): 1s2 2s2 2p6
Электронная конфигурация отрицательного иона (B-): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
3: Плотность водорода при определённых температуре и давлении равна 0.10 г/л. Смесь азота с неизвестным газом при этих же условиях имеет плотность 1.20 г/л. Какой это мог быть газ? Выберите все подходящие варианты:
Неон
Аргон
Аммиак
Углекислый газ
Водород и азот имеют атомные массы 1 и 14 соответственно.
Пусть молярная доля неизвестного газа в смеси будет x. Тогда, масса 1 литра смеси равна (0.1 * 1 + 1.2 * 14) г = 17.2 г.
Молекулярная масса неизвестного газа равна 17.2 / (x + 0.1) г/моль.
Составим уравнение: 17.2 = 14 * 0.1 + (x * 17.2) / (x + 0.1).
Решая это уравнение, получаем x = 0.9.
Таким образом, молярная масса неизвестного газа = (17.2 / 1.9) г/моль = 9 г/моль. Это может быть либо аммиак (NH3), либо неон (Ne).
Оба варианта подходят.
4: Для лучевой терапии рака используют один из радиоактивных изотопов стронция. Его вводят в организм в виде растворимого хлорида, в котором массовая доля металла составляет 55.6%.
Определите массовое число изотопа.
Определите период его полураспада, если известно, что за 101 сутки распадается 75 % изотопа. Ответ выразите в сутках, округлите до десятых.
Ответ: 89; 55,5 суток
5: Заполните пропуски химическими формулами.
При разложении соединения образовалось два простых вещества: 44.8 г металла и 47.04 л (н.у.) негорючего газа .
При разложении нитрата серебра (AgNO3) образуется серебро (Ag) и кислород (O2):
2AgNO3 -> 2Ag + 2NO2 + O2
Масса серебра составляет 44,8 грамма, а объем кислорода равен 47,04 литра при нормальных условиях.
6: Чтобы нагреть воздух в небольшой квартире на 1 градус Цельсия, требуется 200 кДж теплоты. Для этого можно использовать три вида топлива, теплоты сгорания которых приведены в таблице.
Какого топлива потребуется меньше всего по массе?
Угля
Водорода
Метана
Определите его массу. Ответ выразите в граммах, округлите до десятых.
Для решения данной задачи необходимо составить пропорцию. Пусть m1, m2 и m3 — массы угля, водорода и метана, необходимые для нагрева воздуха в квартире на 1 градус Цельсия.
Тогда мы можем составить следующие пропорции:
m1 * 394 кДж/моль = 200 кДж
m2 * 286 кДж/моль = 200 кДж
m3 * 890 кДж/моль = 200 кДж.
Решая эти уравнения, получаем:
m1 = 200 кДЖ / 394 кДЖ/моль ≈ 0,51 г
m2 = 200 кДЖ / 286 кДЖ/моль ≈ 0.70 г
m3 = 200 кДЖ / 890 кДЖ/моль ≈ 0.22 г.
Таким образом, наименьшее количество топлива по массе составляет метан. Масса метана составляет примерно 0.22 грамма.
7:Оксид редкого металла, расположенного в третьей группе Периодической системы, имеет нежный розовый цвет. Массовая доля металла в оксиде равна 87.43 %.
Запишите порядковый номер неизвестного металла — 63
Запишите формулу оксида этого металла.- Eu₂O₃
По условию задачи, металл расположен в третьей группе периодической системы. Это означает, что он находится в третьем столбце (или третьей группе) периодической системы элементов. В третьей группе находятся элементы главных подгрупп: скандий (порядковый номер 21), европий (63) и тербий (65).
Чтобы определить, какой из этих элементов имеет искомые свойства, найдем его атомную массу. Для этого сначала найдем атомную массу кислорода, который входит в состав оксида:
100% — 87,43% = 12,57%
Приняв атомную массу кислорода за 16, составим пропорцию:
16 — 12.57
x — 87.43
x = (16 * 87.43) / 12.57 = 112
Теперь найдем атомный номер металла. Для этого вычтем атомную массу кислорода (16) из найденной атомной массы металла (112):
112 — 16 = 96
Таким образом, искомый металл — европий (его порядковый номер — 63). Формула оксида европия — Eu₂O₃.
8: Заполните пропуски химическими формулами и символами элементов.
Знаменитая скульптура Большого каскада Петергофа выполнена из сплава двух металлов меди и цинка, а снаружи покрыта золотом. Если образец такого сплава массой 10.0 г обработать соляной кислотой, то он растворится в ней лишь частично, выделив 1.2 л (н.у.) водорода и образовав 6.5 г твёрдого остатка — розово-красного порошка ZnCl2, который темнеет на воздухе.
Если к образовавшемуся раствору по каплям добавлять раствор гидроксида натрия, наблюдается выпадение белого осадка вещества Zn(OH)2, который растворяется в избытке щёлочи. Это вещество относится к классу амфотерных гидроксидов. (Выбрать: оксидов/ оснований/ кислот/ амфотерных гидроксидов/ солей)
9: Одной из первой химических реакций, осуществлённых человеком в древние времена, стал синтез синего пигмента, которого не существует в природе. Этот пигмент представляет собой кристаллическое вещество, состоящее из кальция, кремния, кислорода и неизвестного элемента X. Для получения пигмента использовали мел, малахит и кварцевый песок. Массовые доли элементов в синем пигменте: кальций — 10.6 %; кремний — 29.8 %; кислород — 42.6 %.
Запишите химический символ элемента X.- тетрасиликат меди кальция
Запишите химическую формулу синего пигмента, расположив элементы в порядке убывания их атомных масс.- Si4O10CuCa
10: Лекарственный препарат, применяемый при расстройствах пищеварения, состоит из двух бинарных соединений магния: A и B. Массовая доля вещества A в этом препарате составляет 15 %, а B — 85 %. При нагревании соединение A разлагается, превращаясь в B. Это превращение сопровождается выделением газа, простого вещества без цвета и без запаха. Тлеющая лучинка, внесённая в выделяющийся газ, ярко вспыхивает.
Если нагреть 28.0 г данного лекарственного препарата, то после полного превращения A в B масса твёрдого остатка составит 26.8 г.
Бинарные соединения — вещества, состоящие из двух элементов.
Запишите формулы веществ A и B.
A:
B:
Какой объём газа (н.у.) выделяется при нагревании 28.0 г лекарственного препарата, описанного в условии задания? Ответ выразите в миллилитрах, округлите до целых.
A: MgH2
B: MgO
Газ, который выделяется при нагревании — водород.
Его объём составляет: 28 / 248 * 22,4 ≈ 25 мл (где 248 — молярная масса MgH2, 22,4 — молярный объём газа при н. у.)
11: В пробирках, пронумерованных цифрами 1—5, выданы растворы следующих кислот: азотная, серная, хлороводородная, иодоводородная и сероводородная. Из каждой пробирки отобрали пробы растворов по 1 мл, к которым добавили бромную воду. В пробе из пробирки 1 наблюдалось появление интенсивной бурой окраски раствора. В пробе из пробирки 5 жёлто-бурая окраска бромной воды исчезла, раствор помутнел. В пробах из пробирок 2, 3 и 4 изменений не наблюдали.
Затем из пробирок 2, 3 и 4 снова отобрали пробы по 1 мл, к которым добавили раствор хлорида бария. Изменения наблюдались только в пробе из пробирки 3, в ней выпал осадок белого цвета. В пробирки 2 и 4 поместили по кусочку медной проволоки. В пробирке 2 изменений не наблюдалось, а в пробирке 4 медь начала растворяться, из раствора выделялся газ, буреющий на воздухе.
Установите соответствие между номерами и содержимым пробирок.
Иодоводородная кислота
Азотная кислота
Серная кислота
Хлороводородная кислота
Сероводородная кислота
1 — Азотная кислота
2 — Серная кислота
3 — Хлороводородная (соляная) кислота
4 — Иодоводородная кислота
5 — Сероводородная кислота
12: Частицы твёрдых веществ могут находиться во взвешенном состоянии в газообразной или жидкой среде, например, частички пыли в воздухе или частички глины в воде. При определённых условиях под действием силы тяжести частицы твёрдого вещества оседают, этот процесс называют седиментацией. Скорость оседания частиц, имеющих сферическую форму, описывается уравнением: v=29⋅r2(ρ−ρ0)gη,
где v — скорость оседания частиц, r — радиус частиц, ρ — плотность частиц вещества, находящихся во взвешенном состоянии, ρ0 — плотность среды, η — вязкость среды, g — ускорение свободного падения.
Исследовали оседание частичек пыли в воздухе. Какие частички пыли оседают быстрее?
Крупные
Мелкие
Одинаково
Недостаточно данных
Имеется смесь мелких частиц золота и речного песка, близких по размерам. Смесь высыпали в воду. Какие частицы оседают быстрее?
Частицы золота
Частицы речного песка
Одинаково
Недостаточно данных
Исследовали седиментацию частиц кварца в воде. Затем повторили опыт, предварительно растворив в воде сахар. Как изменилась скорость оседания частиц кварца?
Увеличилась
Уменьшилась
Не изменилась
Имеются две партии микроскопических частиц золота сферической формы. Радиусы частиц в первой партии в два раза больше, чем во второй. Золотые частицы из обеих партий поместили в воду. Что наблюдалось?
Частицы золота из разных партий оседают с одинаковой скоростью
Частицы из первой партии оседают в два раза быстрее
Частицы из первой партии оседают в четыре раза быстрее
Важно! Перед тем как списывать, попробуйте решить задания сами.
